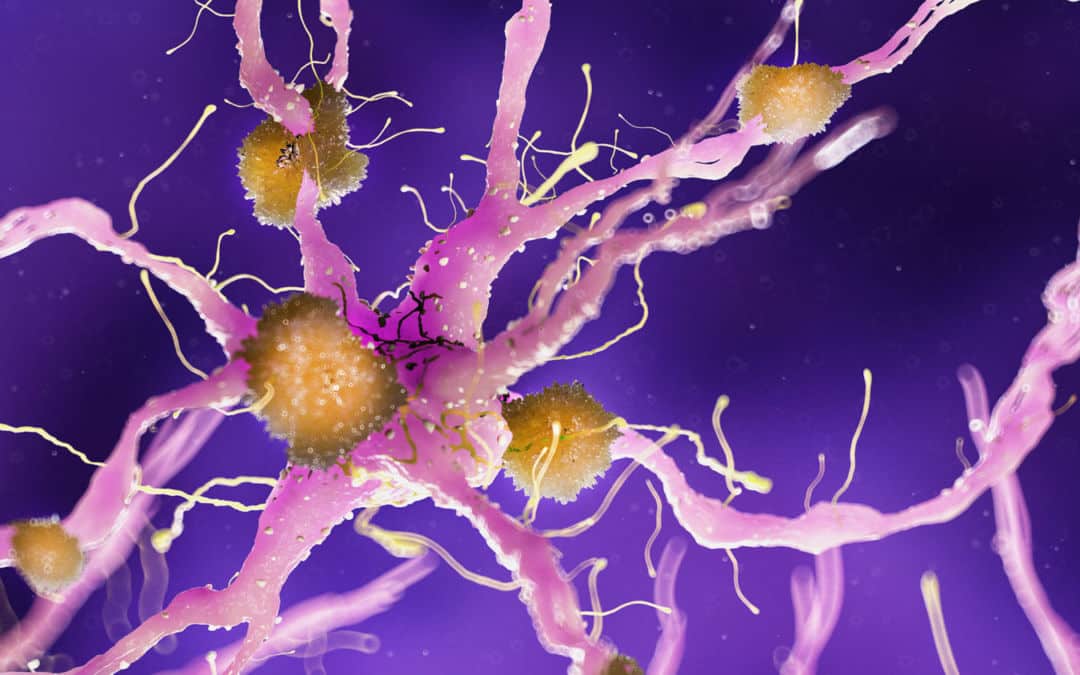
Em diferentes momentos, a aprovação do medicamento aducanumab pela Food and Drug Administration dos EUA teria sido celebrada como um dos grandes avanços terapêuticos de 2021. Afinal, é o primeiro medicamento a atacar as causas do Alzheimer, a forma mais comum de demência.
O Alzheimer afeta milhões de pessoas no mundo: 1,4 milhão só na Itália. Há um punhado de medicamentos que atenuam temporariamente seus sintomas, mas nenhum poderia realmente retardar seu avanço.
Aducanumab, início de subida
Apesar das premissas, a aprovação do FDA tornou-se uma das mais polêmicas. Tudo começa em março de 2019, quando os desenvolvedores do aducanumab, o americano Biogen e os japoneses Eisai, interromper dois grandes ensaios clínicos após um comitê de monitoramento independente determinar que o medicamento não apresenta benefício clínico.
No entanto, a droga parecia fazer o seu trabalho: livrar o cérebro dos pacientes das placas amilóides, os depósitos de proteínas anormais características da doença de Alzheimer. No entanto, como ainda não estava claro se a amiloide causa ou não a doença, a questão foi colocada em espera. No entanto, a Biogen não desistiu: após uma análise mais aprofundada, reapresentou o seu caso em novembro de 2020.
Outra rejeição retumbante, com 10 dos 11 votos contra: "não há evidências substanciais do efeito do aducanumabe", disse o escritório de bioestatística do FDA. Os riscos apresentados pelo aducanumab parecem superar os benefícios.
Fim dos jogos para aducanumab? Não.
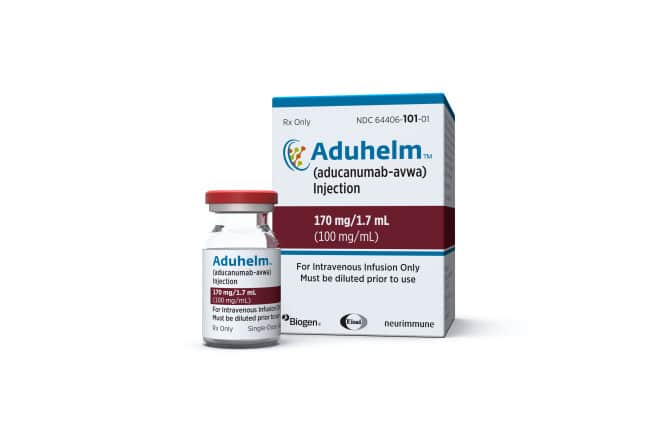
O FDA poderia ter encerrado as coisas aí. Em vez disso, a agência deu luz verde ao aducanumab em junho passado, considerando-o “razoavelmente provável de proporcionar benefícios clínicos”. A Biogen é obrigada a realizar outro estudo, com resultados esperados até 2030: entretanto, pode vender o seu produto (sob o nome comercial aduhelm) a qualquer paciente com Alzheimer.
No mesmo dia, a empresa anunciou o preço de tabela do medicamento nos EUA: mais de 50.000 euros por ano.
E agora é o caos
Associações de pacientes e pesquisadores aplaudiram a decisão do FDA, esperando que o medicamento Biogen funcione. Três membros da diretoria executiva do conselho fiscal renunciaram em protesto, e isso parece apenas o começo.
Até o Congresso dos Estados Unidos lançou duas investigações por parte de tantas comissões sobre como o Aducanumabe foi aprovado e por que custa tanto.
Surgiu um relatório (na imprensa) denunciando uma campanha de "pressão" iniciada pela Biogen para influenciar o FDA.
Outra investigação, desta vez solicitada pelo próprio comissário da FDA, Janete Woodcock. Enquanto isso, alguns centros médicos dizem que não vão prescrever o medicamento.
será que vai dar certo?
Em 2030, quando houver resultados confiáveis, contaremos mais sucessos ou mais danos com essa droga? Na Europa, o EMA rejeitou o uso da droga, muito cedo para saber se vale a pena. Nos Estados Unidos, os médicos estão tomando suas próprias decisões, geralmente informando os pacientes.
“Quando converso com os pacientes sobre o aducanumabe, incluo uma narrativa dos eventos que levaram à sua aprovação”, diz ele Jason Karlawish, geriatra da Escola de Medicina Perelman da Universidade da Pensilvânia.
“As pessoas precisam entender de onde vem algo.”